Stelara (Ustekinumab), un farmaco prodotto da Janssen, azienda farmaceutica, è un trattamento approvato per un tipo di malattia intestinale infiammatoria (IBD), chiamata Morbo di Crohn, per pazienti adulti affetti da questa patologia, sia in stato grave che moderato, per i quali la terapia convenzionale o un antagonista del TNFα (fattore di necrosi tumorale alfa), non siano più efficaci o non siano tollerati o controindicati.
LA SUA FUNZIONE
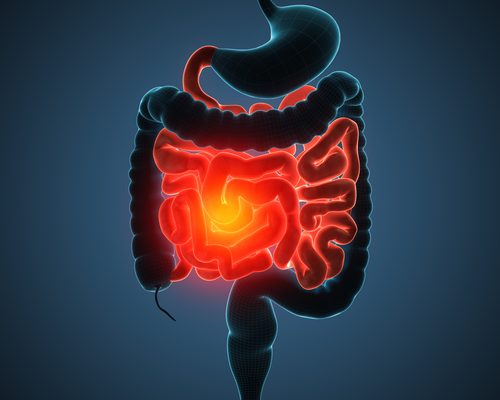
Stelara lavora riducendo il livello di infiammazione nel tratto digestivo, portando alla remissione della patologia del Crohn.
Si tratta di un anticorpo monoclonale, una proteina progettata per mirare e bloccare proteine specifiche. Essa inibisce l’azione di due proteine, le interleuchine (IL)-12 e IL-23, le quali sono citochine infiammatorie (un tipo di proteina che è coinvolto nella risposta infiammatoria come parte del nostro sistema immunitario).
L’approvazione si è realizzata grazie ad una serie di tre studi clinici sviluppati dalla Janssen, su 1400 pazienti affetti dal morbo di Crohn e conclusi con successo.
I risultati sono stati pubblicati su The New England Journal of Medicine.
Ustekinumab è stato tollerato, sia nella fase di induzione, sia in quella di mantenimento in tutti e tre gli stadi e il profilo di sicurezza del farmaco è rimasto coerente nei cinque anni di dati cumulativi acquisiti nei pazienti affetti da psoriasi (con iniezioni sottocutanee fino a 90 mg), e nei due anni di dati di sicurezza, relativi a pazienti affetti da artrite psoriasica.
Nello studio di mantenimento IM-UNITI, controllato con placebo, sono stati riportati eventi avversi in proporzioni simili nei gruppi sottoposti a trattamento con ustekinumab e con placebo, la maggioranza dei quali erano relativi a disturbi gastrointestinali (dolore addominale e diarrea) e infezioni. Gli eventi avversi gravi riportati sono risultati simili nei gruppi trattati con ustekinumab e in quelli trattati con placebo e non sono stati riportati né decessi né eventi avversi cardiovascolari gravi.
Procedimento
Il farmaco viene somministrato inizialmente per via endovenosa per un dosaggio di 6 mg/Kg. Seguono somministrazioni sottocute, ogni 2-3 mesi a seconda dei casi. La prima somministrazione di mantenimento per via sottocutanea è da farsi dopo l’ottava settimana per via endovenosa. A seguire, si raccomanda una dose ogni 12 settimane.
ALTRE INFORMAZIONI
Nel settembre del 2016, Stelara ha ricevuto l’approvazione finale da parte dell’American Food and Drug Administration (FDA), come trattamento per la malattia di Crohn.
L’approvazione dell’autorizzazione alla commercializzazione fa seguito al parere positivo espresso il 15 settembre 2016 dal Comitato Europeo per i Prodotti Medicinali per Uso Umano (CHMP) dell’Agenzia Europea dei Medicinali (EMA).Tale approvazione consente la commercializzazione di ustekinumab in tutti e 28 gli stati membri dell’Unione Europea e nei paesi appartenenti all’Area Economica Europea (Norvegia, Islanda e Liechtenstein).